Patología B 2014, UNLP
lunes, 23 de junio de 2014
domingo, 22 de junio de 2014
LINFOMA DIFUSO DE CÉLULAS B GRANDES
INTRODUCCIÓN
Se llama así porque tienen su origen en células de línea B, las células tumorales son linfocitos de tamaño grande, y tiene un patrón difuso de invasión de los ganglios linfáticos.
Es un linfoma de crecimiento rápido, con una tasa elevada de proliferación celular y comportamiento agresivo
EPIDEMIOLOGÍA
- Los Linfomas difusos de células B grandes constituyen aproximadamente el 48% del total de linfomas.
- Comprende entre el 30 y el 40 % de todos los linfomas del adulto
- Afecta sobre todo a adultos, estando la edad media por encima de los 60 años. Rara vez afecta a menores de 20 años. La incidencia aumenta gradualmente a partir de los 50 años.
- La mayoría de los casos son formas “de novo “ pero pueden ser la progresión ó transformación de una enfermedad linfoproliferativa previa
- Es una neoplasia de curso agresivo pero potencialmente curable (50 % de los pacientes)
DIAGNÓSTICO
• Debe realizarse en tejido ganglionar o extraganglionar obtenido por biopsia
• Inmunohistoquímica mínima obligatoria: CD45, CD20 y CD3; complementada con BCL-2, BCL-6,
CARACTERÍSTICAS MORFOLOGICAS
Se caracteriza por una infiltración difusa que borra completa o parcialmente la arquitectura interfolicular o sinusoidal.
Las variantes morfológicas son:
- Centroblástico
- Inmunoblástico
- Anaplásico
Centroblástico
Es el más común, con células medianas a grandes, escaso citoplasma, núcleos
con dos a cuatro nucléolos.
Inmunoblástico
Más del 90% son células grandes con citoplasma basófilo, núcleo con
nucléolo central prominente.
Anaplásico
Las células que lo componen infiltran sinusoides o se presentan en forma cohesiva
simulando metástasis. Son de gran tamaño, con amplio citoplasma.
CARACTERÍSTICAS GENETICAS
Reordenamiento de BCL-2 ~ 20%
Reordenamiento de BCL-6 ~ 30%
Mutación de BCL-6 ~ 70%
Reordenamiento de MYC: 9-17%
EBV usualmente negativo excepto en inmunodeficiencia.
CLINICA
La presentación más característica es una tumoración de reciente aparición en una o más regiones ganglionares o en cualquier otra localización.
Es fácil de detectar precozmente si el abultamiento es palpable, aunque en la mayoría de las veces no produce dolor.
Las regiones cervicales y abdominales son las que se encuentran generalmente afectadas.
Localizaciones extraganglionares
• Tracto gastro-intestinal
- Estómago (Gástrico)
- Intestinal
• Cervicales y Faciales
- Órbita ocular
- Faringe y senos paranasales
- Amígdala
- Glándulas salivares y parótida
- Tiroides
• Linfoma Cerebral
• Cutáneo
• Mamario
• Pulmón
• Hueso (Óseo)
• Hígado
• Riñón
• Testículo
• Tracto genital femenino
- Ovario
- Útero
PRESENTACIÓN DE UN CASO
Paciente de 44 años consultó al Servicio de Ginecología por menometrorragias ( hemorragia uterina abundante proveniente de los genitales femeninos) y útero miomatoso diagnosticado por ecografía. Por tacto se advertía una masa nodular y dura de 2cm.
Las biopsias de cuello mostraban cervicitis crónica y la biopsia de vagina mostró una proliferación de células de hábito linfoide de mediano y gran tamaño con núcleos irregulares con marcada positividad para CD 20, CD 79a y BCL-6, alto índice de proliferación y una positividad focal para
BCL-2
El estudio fue concluyentede Linfoma no Hodgkin difuso de célula grande tipo B. La anamnesis dirigida no manifestó síntomas B (Con síntomas sistémicos fiebre > 38°, sudoración nocturna, pérdida de
peso de > 10% en los últimos 6 meses)
En el estudio con tomografía de emisión de positrones se observaron focos de intenso hipermetabolismo
a nivel vaginal y hepático sin embargo las biopsias de médula ósea y hepáticas fueron negativas para
malignidad.
Ante el diagnóstico de linfoma no Hodgkin primario de vagina estadio IE A se inició quimioterapia (In ltración localizada de un solo órgano o sitio extralinfático)
Después de 3 ciclos de quimioterapia se solicitó una tomografía computarizada de control observándose persistencia de la masa paravaginal izquierda sin modificación de su tamaño optándose por erradicación quirúrgica. Se realizó histerectomía total. El estudio histológico fue negativo para malignidad en todo el material recibido, vagina con ligero edema y un mínimo infiltrado inflamatorio crónico poco significativo. Actualmente en seguimiento.
BIBLIOGRAFÍA
Onco Guía. Linfoma No Hodgkin. Juan Rafael Labardini Méndez. Instituto Nacional de Cancerología. San Fernando #22. Col. Sección XVI, Tlalpan. C.P. 14080. México D.F.
Casos Clínicos. Linfoma no Hodgkin primario de vagina
Eva María Guldrís, María Pía Vázquez, Elba Carballo, Magdalena Porto,
Luis Heliodoro Alba , Begoña Iglesias. Complejo Hospitalario Universitario de Vigo.
Pontevedra. España.
http://www.fcarreras.org/es/linfoma-no-hodgkin_364472
http://www.cancer.org/acs/groups/cid/documents/webcontent/002315-pdf.pdf
http://www.sah.org.ar/docs/251-274.5B.SAH_GUIA2012_LinfomaCelulasGrandes_1.pdf
http://www.geth.es/index.php?option=com_content&task=view&id=356&Itemid=25
http://www.todopapas.com/diccionario/ginecologia/menometrorragia-618
domingo, 1 de junio de 2014
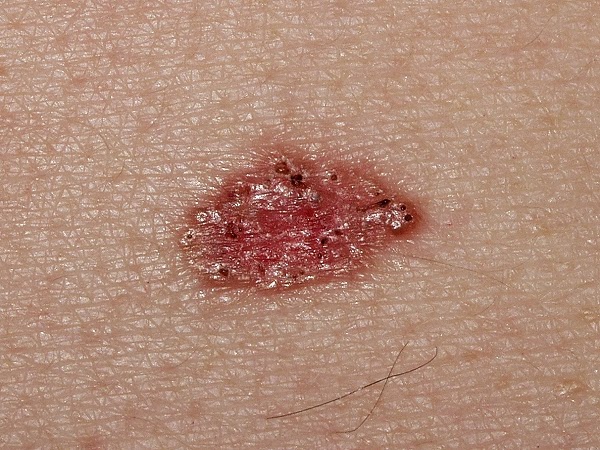
CARCINOMA BASOCELULAR
INTRODUCCIÓN
El Carcinoma Basocelular (CBC) es el tumor maligno más
común en los seres humanos con una incidencia de 185 a 422
casos por 100.000 habitantes en la población caucásica. Su frecuencia
se incrementa con la edad y comienza a aumentar
rápidamente a partir de los 50 años de edad.
Representa aproximadamente entre un 70 a un 80 % de
los cánceres cutáneos no melanoma, en la población de color de piel blanca y su
tasa de incidencia ha incrementado un 20 % en las últimas 2 décadas.
El carcinoma basocelular (CBC) es una neoplasia cutánea
originada en las células basales de la epidermis
y folículos pilosos; localmente es infiltrante, si se deja
evolucionar es destructivo, y de manera excepcional
causa metástasis. Forma parte de los carcinomas cutáneos
no melanoma (CCNM).
HISTORIA
En el caso del CBC el gen más afectado es el PTCH (PTCH1 actúa como un gen supresor de tumor en la vía Sonic Hedgehog, esencial en la regulación de la organogénesis, relacionado al control de la diferenciación celular y proliferación), ; le siguen mutaciones puntuales en el gen p53, puede presentar varios subclones con mutaciones diferentes del gen p53 en distintas partes del tumor. En un pequeño número de CBC se han descrito mutaciones en el locus CDKN2A, que codifica p16 y p14. A diferencia de los genes supresores de tumores, parece que los oncogenes tienen menos importancia, como el gen ras, con una frecuencia de mutación entre 0 y 30%. En el CBC se expresa una cantidad de telomerasas igual o mayor que los tumores de alto grado de malignidad.
Se puede afirmar que en su origen intervienen factores extrínsecos e intrínsecos.
Patrones Histológicos:
Patrón nodular: agregados de células basaloides bien circunscritos, de forma y de tamaño variable; se disponen en la dermis de forma expansiva pudiendo mantener conexión con la epidermis o el epitelio folicular. Las células centrales se disponen de forma mas desordenada. La retracción peritumoral del estroma.
Patrón superficial: gemaciones y proliferaciones de células basaloides que se originan de la epidermis, mantienen contacto con ella y tienen poca penetración en la dermis. Las gemaciones de
células basaloides se suceden a intervalos, son de pequeño tamaño, contornos bien definidos, redondeados y de base ancha unida a la epidermis.
Patrón micronodular: Se caracteriza por presentar células basaloides que se disponen en múltiples islotes pequeños y redondeados de tamaño similar al de los bulbos pilosos; estos islotes poseen un patrón de crecimiento disperso y asimétrico; extendiéndose lateralmente y en profundidad; la retracción peritumoral del
estroma es poco frecuente.
Patrón morfeiforme: Se caracteriza por ser un tumor poco circunscrito que infiltra y se extiende en profundidad a la dermis o los tejidos profundos. Está compuesto por células basaloides dispuestas en islotes pequeños así como en cordones angostos (dos capas de células) y angulados. El estroma que rodea al tumor es un estroma colagenoso.
Patrón Infiltrativo: presencia de islotes de células tumorales de diversos tamaños; colecciones o bandas elongadas del ancho de 4 a 8 capas de células de contornos irregulares. La demarcación entre el tumor y el estroma es pobre y no existe incremento en el número de fibroblastos ni mayor densidad
del colágeno.
Patrón basoescamoso: islotes formados por células basaloides típicas de CBC junto con focos de células con diferenciación escamosa que simulan un carcinoma espinocelular.
CLÍNICA
Molecular pathogenesis of keratocystic odontogenic tumors developing in nevoid basal cell carcinoma syndrome. Maiko Suzuki, MD,a Kazuaki Nagao, MSc,a Hiromi Hatsuse, BS,a Ryo Sasaki, DDS,b Kayoko Saito, MD, PhD,c Katsunori Fujii, MD, PhD,d and Toshiyuki Miyashita, MD, PhDa Kitasato University Graduate School of Medical Sciences, Sagamihara, Japan; Tokyo Women’s Medical University, Tokyo, Japan; and Chiba. University Graduate School of Medicine, Chiba, Japan. Vol. 116 No. 3 September 2013
Correlación clínica, histológica y dermatoscópica del carcinoma basocelular. Daniel Alcalá Pérez,* Armando Medina Bojórquez. Rev Cent Dermatol Pascua • Vol. 22, Núm. 1 • Ene-Abr 2013
Comportamiento del carcinoma basocelular facial en Artemisa durante la última década. Revista Cubana de Estomatología 2011;48(2):121-128
Páginas:
http://dermatoweb2.udl.es/atlasg.phpidfoto=403839&lletra=c&pag=2&idsubmenu=2454&idapartat=3366&idsubapartat=
http://dermatoweb2.udl.es/atlasg.phpidfoto=397381&lletra=c&pag=1&idsubmenu=2454&idapartat=3368&idsubapartat=
El Carcinoma Basocelular (CBC) es el tumor maligno más
común en los seres humanos con una incidencia de 185 a 422
casos por 100.000 habitantes en la población caucásica. Su frecuencia
se incrementa con la edad y comienza a aumentar
rápidamente a partir de los 50 años de edad.
Representa aproximadamente entre un 70 a un 80 % de
los cánceres cutáneos no melanoma, en la población de color de piel blanca y su
tasa de incidencia ha incrementado un 20 % en las últimas 2 décadas.
El carcinoma basocelular (CBC) es una neoplasia cutánea
originada en las células basales de la epidermis
y folículos pilosos; localmente es infiltrante, si se deja
evolucionar es destructivo, y de manera excepcional
causa metástasis. Forma parte de los carcinomas cutáneos
no melanoma (CCNM).
HISTORIA
- Los primeros reportes sobre la existencia del CBC fueron realizados hace más de 4,000 años, en esqueletos de momias del antiguo Egipto
- El término «noli-me-tangerec», que significa «no deseo que me toques», identificó a este tumor durante el siglo XIV.
- Posteriormente se introdujo el término «ulcus rodents» por su apariencia similar a la mordedura de una rata
- En 1903, Krompecher introdujo el término «epitelioma de
- células basales», basado en su similitud con las células de la capa basal epidérmica
MUTACIONES GENÉTICAS
En el caso del CBC el gen más afectado es el PTCH (PTCH1 actúa como un gen supresor de tumor en la vía Sonic Hedgehog, esencial en la regulación de la organogénesis, relacionado al control de la diferenciación celular y proliferación), ; le siguen mutaciones puntuales en el gen p53, puede presentar varios subclones con mutaciones diferentes del gen p53 en distintas partes del tumor. En un pequeño número de CBC se han descrito mutaciones en el locus CDKN2A, que codifica p16 y p14. A diferencia de los genes supresores de tumores, parece que los oncogenes tienen menos importancia, como el gen ras, con una frecuencia de mutación entre 0 y 30%. En el CBC se expresa una cantidad de telomerasas igual o mayor que los tumores de alto grado de malignidad.
El primer paso en la aparición del carcinoma basocelular es una mutación germinal en el PTCH1 (primer golpe), seguido de una mutación somática de inactivación o deleción de dicho gen (segundo golpe).
FACTORES DE RIESGO
Se puede afirmar que en su origen intervienen factores extrínsecos e intrínsecos.
Dentro de los extrínsecos se encuentran factores del medio ambiente como la radiación ultravioleta, radiaciones ionizantes, traumatismos, exposición a hidrocarburos policíclicos aromáticos, clorofenoles y arsénico. La exposición solar es capaz de inducir disminución de la vigilancia antitumoral. A nivel molecular aumenta la síntesis de prostaglandinas por inducción de la ciclooxigenasa-2 (COX-2), produce inmunosupresión, daña el ADN, altera su proceso de reparación y en el 40-50% de los casos genera mutaciones del p53; además, induce la formación de fotodímeros de pirimidina, aumentando las mutaciones de los protooncogenes de la familia ras y del gen supresor tumoral PTCH.
Los intrínsecos o genéticos dependen del huésped, entre éstos podemos encontrar síndromes genéticos
con fotosensibilidad como el xeroderma pigmentoso, el albinismo y el síndrome de carcinomas basocelulares nevoides o síndrome de Gorlin.
CARACTERÍSTICAS HISTOLÓGICAS
- Presencia de islotes o cordones de células basaloides, bien circunscritos que adquieren tamaño y forma variable.
- En la periferia de los islotes, las células basaloides se disponen en empalizada; aquellas localizadas en el centro se disponen al azar.
- Por fuera del islote tumoral se evidencian áreas de separación o retracción del estroma.
- La célula basaloide posee un núcleo uniforme, redondeado u oval, hipercromático con cromatina densamente agrupada, nucleolo; y citoplasma escaso poco definido
se describen seis patrones básicos:
- nodular
- superficial
- micronodular
- morfeiforme
- infiltrativo
- basoescamoso;
Los cuatro últimos patrones presentan comportamiento agresivo. El comportamiento biológico de
Patrón nodular: agregados de células basaloides bien circunscritos, de forma y de tamaño variable; se disponen en la dermis de forma expansiva pudiendo mantener conexión con la epidermis o el epitelio folicular. Las células centrales se disponen de forma mas desordenada. La retracción peritumoral del estroma.
Patrón superficial: gemaciones y proliferaciones de células basaloides que se originan de la epidermis, mantienen contacto con ella y tienen poca penetración en la dermis. Las gemaciones de
células basaloides se suceden a intervalos, son de pequeño tamaño, contornos bien definidos, redondeados y de base ancha unida a la epidermis.
Patrón micronodular: Se caracteriza por presentar células basaloides que se disponen en múltiples islotes pequeños y redondeados de tamaño similar al de los bulbos pilosos; estos islotes poseen un patrón de crecimiento disperso y asimétrico; extendiéndose lateralmente y en profundidad; la retracción peritumoral del
estroma es poco frecuente.
Patrón morfeiforme: Se caracteriza por ser un tumor poco circunscrito que infiltra y se extiende en profundidad a la dermis o los tejidos profundos. Está compuesto por células basaloides dispuestas en islotes pequeños así como en cordones angostos (dos capas de células) y angulados. El estroma que rodea al tumor es un estroma colagenoso.
Patrón Infiltrativo: presencia de islotes de células tumorales de diversos tamaños; colecciones o bandas elongadas del ancho de 4 a 8 capas de células de contornos irregulares. La demarcación entre el tumor y el estroma es pobre y no existe incremento en el número de fibroblastos ni mayor densidad
del colágeno.
Patrón basoescamoso: islotes formados por células basaloides típicas de CBC junto con focos de células con diferenciación escamosa que simulan un carcinoma espinocelular.
CLÍNICA
Puede presentarse como una pápula, placa, nódulo o tumor que característicamente luce perlada con la presencia de telangiectasias en su superficie.
Puede presentar áreas de hipopigmentación, atrofia y cicatrización o tener coloración marrón, azul o negra.
BIBLIOGRAFÍA
Artículos:
Características Clínicas e Histológicas del Carcinoma Basocelular. Katrina Fernández, Ana Rita Rodríguez de Valentiner, Marina Chópite, Carmen López, Oscar Reyes Jaimes, Margarita Oliver*. Sección de Dermopatología, Instituto de Biomedicina, Hospital Vargas.
BIBLIOGRAFÍA
Artículos:
Características Clínicas e Histológicas del Carcinoma Basocelular. Katrina Fernández, Ana Rita Rodríguez de Valentiner, Marina Chópite, Carmen López, Oscar Reyes Jaimes, Margarita Oliver*. Sección de Dermopatología, Instituto de Biomedicina, Hospital Vargas.
Molecular pathogenesis of keratocystic odontogenic tumors developing in nevoid basal cell carcinoma syndrome. Maiko Suzuki, MD,a Kazuaki Nagao, MSc,a Hiromi Hatsuse, BS,a Ryo Sasaki, DDS,b Kayoko Saito, MD, PhD,c Katsunori Fujii, MD, PhD,d and Toshiyuki Miyashita, MD, PhDa Kitasato University Graduate School of Medical Sciences, Sagamihara, Japan; Tokyo Women’s Medical University, Tokyo, Japan; and Chiba. University Graduate School of Medicine, Chiba, Japan. Vol. 116 No. 3 September 2013
Correlación clínica, histológica y dermatoscópica del carcinoma basocelular. Daniel Alcalá Pérez,* Armando Medina Bojórquez. Rev Cent Dermatol Pascua • Vol. 22, Núm. 1 • Ene-Abr 2013
Comportamiento del carcinoma basocelular facial en Artemisa durante la última década. Revista Cubana de Estomatología 2011;48(2):121-128
Páginas:
http://dermatoweb2.udl.es/atlasg.phpidfoto=403839&lletra=c&pag=2&idsubmenu=2454&idapartat=3366&idsubapartat=
http://dermatoweb2.udl.es/atlasg.phpidfoto=397381&lletra=c&pag=1&idsubmenu=2454&idapartat=3368&idsubapartat=
lunes, 19 de mayo de 2014
CITOPATOLOGÍA DE LAS LESIONES DEL CUELLO UTERINO. DISPLASIAS
INTRODUCCIÓN
Se conocen más de 150 tipos de VPH, de los cuales más de 40 infectan el área genital y
anal. De estos, unos 15 son oncogénicos (de alto riesgo los tipos 16
y 18). La mayoría de las infecciones por virus de alto riesgo son subclínicas y tienden a
establecer infecciones persistentes, ocasionando cambios detectables en la citología o la
colposcopia. Otras veces, la infección queda latente siendo detectable únicamente por análisis
del ADN viral.
DESARROLLO
En 1950 se propuso el término Displasia para describir las lesiones precancerosas cervicales.
Este término se ha usado para indicar lesiones epiteliales cervicales con una progresión alterada
y que muestran atipia nuclear y proliferación anormal de células escamosas basaloides con
aumento de la relación núcleo:citoplasma y dispolaridad.
La Displasia fue subdividida en leve, moderada y severa según la extensión de los
cambios dentro del epitelio.
Luego Richart propone reemplazar los términos existentes y unificarlos bajo el
concepto histológico de lesiones precancerosas intraepiteliales cervicales bajo la denominación
de Neoplasia intraepitelial cervical (CIN) que fue posteriormente subdividida en:
Se conocen más de 150 tipos de VPH, de los cuales más de 40 infectan el área genital y
anal. De estos, unos 15 son oncogénicos (de alto riesgo los tipos 16
y 18). La mayoría de las infecciones por virus de alto riesgo son subclínicas y tienden a
establecer infecciones persistentes, ocasionando cambios detectables en la citología o la
colposcopia. Otras veces, la infección queda latente siendo detectable únicamente por análisis
del ADN viral.
DESARROLLO
En 1950 se propuso el término Displasia para describir las lesiones precancerosas cervicales.
Este término se ha usado para indicar lesiones epiteliales cervicales con una progresión alterada
y que muestran atipia nuclear y proliferación anormal de células escamosas basaloides con
aumento de la relación núcleo:citoplasma y dispolaridad.
La Displasia fue subdividida en leve, moderada y severa según la extensión de los
cambios dentro del epitelio.
Luego Richart propone reemplazar los términos existentes y unificarlos bajo el
concepto histológico de lesiones precancerosas intraepiteliales cervicales bajo la denominación
de Neoplasia intraepitelial cervical (CIN) que fue posteriormente subdividida en:
- CIN 1 (correspondiente a displasia leve)
- CIN 2 (displasia moderada)
- CIN 3 (displasia severa/carcinoma in situ)
Podemos clasificar las lesiones causadas por HPV en dos grandes grupos:
Lesiones causadas por HPV de bajo riesgo: habitualmente regresan espontáneamente, e histológicamente muestran evidencia de infección viral activa con pronunciados cambios víricos citopáticos y evidencia de replicación viral. Ejemplos son: condiloma, displasia escamosa leve, LSIL (Lesión
Intraepitelial Escamosa de Bajo Grado) y CIN 1
Lesiones causadas por HPV de alto riesgo: corresponde a lesiones precancerosas escamosas conocidas como displasia moderada o severa, carcinoma in situ, CIN 2 y 3 y Lesión Intraepitelial Escamosa de Alto Grado (HSIL). Pueden progresar a carcinoma invasivo si no se tratan.
Citopatología de las lesiones escamosas
Lesión intraepitelial escamosa de bajo grado
Incluye las categorías de CIN 1
y displasia leve
Histológicamente se caracteriza por:
- Células escamosas maduras con grandes núcleos, 4-6 veces el tamaño de los núcleos de células intermedias normales.
- Las células son generalmente aisladas pero pueden verse en grupo
- Pueden mostrar cambios claros asociados con infección por HPV. Este cambio es el halo perinuclear citoplasmático (coilocitosis).
Núcleo:
- Gran tamaño
- Hipercromatismo
- Membranas nucleares irregulares
- Frecuente binucleación.
- Cromatina es típicamente granular fina y uniformemente distribuida.
- Raramente hay nucleolos
Un coilocito diagnóstico tiene un halo perinuclear claro ópticamente bien definido, con un ribete periférico de citoplasma denso y al menos algún grado de anormalidad nuclear. Los cambios nucleares vistos pueden consistir en agrandamiento nuclear, membrana nuclear arrugada, hipercromasia, bi y multinucleación y cambios degenerativos como picnosis.
Lesión intraepitelial escamosa de alto grado:
Comprende las categorías de displasia moderada y severa, CIN II y Carcinoma in situ.
Características Histológicas:
- Células con citoplasma inmaduro
- Núcleos de características anormales.El tamaño nuclear de las células de HSIL es de dos a cinco veces el del núcleo de una célula intermedia. son hipercromáticos con cromatina granular gruesa, las membranas nucleares tiene aspecto arrugado y hay anisonucleosis (variación en el tamaño y forma nuclear)
- Aumento de la relación núcleo:citoplasma.
- Las células se presentan aisladamente o en grupos o incluso en agregados sincitiales.
Las dos diferencias más importantes entre LSIL y HSIL es la inmadurez del citoplasma y la elevada relación
núcleo:citoplasma.
La displasia queratinizante es una variante de HSIL. A diferencia de las células inmaduras, hay células con citoplasma queratinizado hipermaduro
Carcinoma escamoso:
Hay dos variantes morfológicas, queratinizante y no queratinizante.
El carcinoma escamoso no queratinizante se caracteriza por:
- muchas células aisladas y grupos sincitiales
- células son inmaduras con relación núcleo:citoplasma alta pero a menudo con más citoplasma que las de HSIL
- nucleolo prominente,distribución irregular de la cromatina y membrana nuclear
- irregular.
Las características citológicas del carcinoma escamoso queratinizante son:
- células aisladas y ocasionales grupos
- marcada variación de la morfología de las células con presencia de células alargadas y citoplasmas densos eosinófilos
- núcleos opacos y alta relación núcleo:citoplasma.
BIBLIOGRAFÍA:
GUÍA CLÍNICA DE LA PATOLOGÍA CERVICAL.Fundación Instituto Valenciano de Oncología. COORDINACIÓN: ENRIQUE GARCÍA. Año 2008
http://www.salud.com.ar/es/papanicolau-o-pap.html
http://www.msal.gov.ar/index.php/component/content/article/48/105-virus-del-papiloma-humano-vph-o-hpv
http://www.msal.gov.ar/index.php/programas-y-planes/185-vph
http://nih.techriver.net/view.php?patientId=205
http://sunnybrook.ca/glossary/item.asp?g=4&i=948&page=
lunes, 12 de mayo de 2014
SARCOIDOSIS
La Sarcoidosis es una enfermedad multisistémica de causa desconocida, que frecuentemente se presenta con adenopatía hiliar bilateral, infiltración pulmonar, lesiones cutáneas y oculares.
HISTORIA:
Descrita por primera vez por Hutchinson, bajo el nombre de "psoriasis papilar" en 1877
Boeck en 1898 acuñó el término "Sarkoid"
Schaumann describe el carácter multisistémico de la enfermedad entre 1914 y 1924 bajo el nombre de "linfogranulomatosis benigna"
DEFINICIÓN
“La Sarcoidosis es una enfermedad multisistémica de
causa desconocida. Comúnmente afecta jóvenes y adultos
de edad media. Frecuentemente se presenta con adenopatía
hiliar bilateral, infiltración pulmonar, lesiones cutáneas y
oculares. Pueden estar afectados el hígado, bazo, ganglios
linfáticos, glándulas salivares, corazón, sistema nervioso,
huesos y otros órganos”
World Association for Sarcoidosis and Other Granulomatosis 1999
INFLUENCIA GENÉTICA
La predisposición a adquirir Sarcoidosis parece genéticamente determinada, sin embargo solo un pequeño grupo de alelos de HLA han sido posibles de identificar asociados a la susceptibilidad de la enfermedad, tanto de clase I (HLA B7, HLA B8), como de clase II (HLA-DR3, DR5, DR6, DR8, DR9, DR14, DR15 y DR17).
ETIOLOGÍA
La causa es desconocida. Actualmemte, existen varias investigaciones que buscan el/los agentes etiológicos, responsables de la manifestación clínica de dicha enfermedad. Expertos dicen que se trata de un síndrome que puede deberse a muchos factores precipitantes. Otros piensan que hay un ùnico agente antigénico aún no determinado.
INMUNOPATOGENIA
Ante la llegada de un Antígeno (de naturaleza desconocida) se produce la activación de Rc de Reconocimiento de Patrones asociados al daño, como los Rc tipo Toll 2 y 9, los Rc de Lecticas tipo C y los Rc tipo NOD. Es presentado por las CPA a los Linfocitos T, lo que inicia la acumulación y proliferación de CTCD4+ con perfil Th1. Éstos liberan múltiples citocinas, dentro de las que encontramos la IL-1, IL-2, IL-15, IL-18 e IFNgamma, que llevan a la acumulación y activación de monocitos y macrófagos lo que se desencadena en la formación de un granuloma, formación redondeada de 0.5 a 2 mm. Por fuera se encuentan las células epiteliodes, con las células de Langhans; luego existe una corona de Linfocitos y más externamente una capa de fibroblástos. El mantenimiento del granuloma parece deberse a la influencia de la IL-12.
La respuesta inmune es exagerada por la ausencia de mecanismos de retroalimentación negativa por los Treg (que en condiciones normales finalizan la respuesta inmune)
Hay casos de pacientes en que se ha producido una resolución espontánea del granuloma, y si bien el motivo exacto no se conoces, se evidencia una concentración de TGFbeta elevada.
MANIFESTACIONES CLÍNICAS
Sarcoidosis endotorácica
Es el punto de impacto más frecuente en pacientes con patología activa. La adenopatía hiliar bilateral es el hallazgo habitual. El compromiso intratorácico puede ser completamente asintomático, o presentar síntomas pulmonares como tos, disnea, dolor torácico, o raramente, hemoptisis.
Sarcoidosis cutánea
Las lesiones cutáneas pueden ser específicas o inespecíficas. Las formas específicas son aquellas en las que se puede demostrar el granuloma sarcoidal y las inespecíficas las que corresponden a procesos reactivos.
DERMOPATOLOGÍA
Las típicas lesiones cutáneas muestran epidermis con hipotrofia regular y aplanamiento de crestas interpapilares. En la dermis se observan granulomas tuberculoides no necrotizantes, redondeados, diseminados, dejando sectores respetados. Están constituidos por abundantes células epitelioides, número variable de células gigantes multinucleadas y escasa corona linfomonocitaria (tubérculos «desnudos»).
Pueden existir leve necrosis de coagulación y mínima fibrina en el centro de los tubérculos. En las células gigantes pueden evidenciarse cuerpos de Schaumann y asteroides. Estos últimos, formados por colágeno. Son eosinófilos, de aspecto “estelar”. Los cuerpos de Schaumann son redondos u ovales, laminados
y calcificados.
Granulomas dérmicos sarcoidales "desnudos"
Diagnósticos diferenciales:
- LES
- Granuloma por cuerpo extraño
- Lepra tuberculoide
Otras manifestaciones Clínicas más comunes incluyen:
Sarcoidosis Ocular
Sarcoidosis cardíaca: las arritmias son las manifestaciones más frecuentes. Los trastornos de conducción auriculoventricular, incluyendo el bloqueo completo, pueden llevar a la muerte súbita. El proceso infiltrativo
de la sarcoidosis puede simular un proceso coronario agudo
Sarcoidosis ganglionar: Habitualmente los ganglios aumentan de tamaño, no son confluentes, no se adhieren a planos superficiales ni profundos, y no son dolorosos. Los grupos ganglionares más afectados, fuera de los endotorácicos, son los cervicales, los supraclaviculares, los inguinales, los axilares,los epitrocleares y los mandibulares.
Sarcoidosis hepática y esplénica: El compromiso del higado puede llegar hasta un 80%, pero no presenta síntomas hasta la presencia de colestasis o, en casos avanzados, cirrosis e hipertensión portal.
La esplenomegalia es generalmente moderada y transitoria.
PARÁMETROS PARA SU DIAGNÓSTICO Y ESTUDIO INTEGRAL
• Antecedentes personales y laborales.
• Examen Físico.
• Patología (piel, ganglio, labio, etc.).
• Radiología (tórax, huesos de la mano y pies).
• Estudio Funcional Respiratorio (espirometría, gases en sangre).
• Imagenología pulmonar (TAC de Alta Resolución, Centellografía con Galio67, PET).
• Lavado bronco-alveolar.
• Hemograma completo (linfopenia marca actividad sarcoidal).
• Hepatograma completo.
• Dosaje de inmunoglobulinas (IgG).
• Calcemia y Calciuria.
• Enzimas séricas (aumento de Enzima Convertidora de Angiotensina).
• Electrocardiograma.
• Examen oftalmológico.
TRATAMIENTO
- Corticoides
- Antipalúdicos
Educación Médica Continuada.Sarcoidosis. A global approach
C.Fernando Gatti1, P.Prahl2, P.Troielli3, R.Schroh4
1Profesor Asociado de Dermatología.Facultad de Medicina.Universidad del Salvador.Buenos Aires.Director del Insitituto de Medicina Cutánea
de Buenos Aires. 2Médico Dermatólogo.Instituto de Medicina Cutánea de Buenos Aires. 3Médica Dermatóloga. Servicio de Dermatología.
Instituto de Investigaciones Médicas.Universidad de Buenos Aires. 4Docente Autorizado de Patología.Facultad de Medicina.Universidad de
Buenos Aires.Dermato-patólogo del Instituto de Medicina Cutánea de Buenos Aires.
Sarcoidosis. Dominique Valeyre, Antje Prasse, Hilario Nunes, Yurdagul Uzunhan, Pierre-Yves Brillet, Joachim Müller-Quernheim
Robbins, Patología funcional y estructural. Octava edición
Suscribirse a:
Comentarios (Atom)